Il morbo di Alzheimer, detta anche demenza senile di tipo Alzheimer, demenza degenerativa primaria di tipo Alzheimer o semplicemente di Alzheimer, è la forma più comune di demenza degenerativa invalidante ad esordio prevalentemente senile (oltre i 65 anni, ma può manifestarsi anche in epoca presenile - prima dei 65 anni).
Caratteristiche generali
Essa è stata descritta per la prima volta nel 1906, dallo psichiatra e neuropatologo tedesco Alois Alzheimer. Nel 2006 vi erano 26,6 milioni malati di tutto il mondo, e si stima che ne sarà affetta 1 persona su 85 a livello mondiale entro il 2050.
La sua ampia e crescente diffusione nella popolazione, la limitata e comunque non risolutiva efficacia delle terapie disponibili, e le enormi risorse necessarie per la sua gestione (sociali, emotive, organizzative ed economiche), che ricadono in gran parte sui familiari dei malati, la rendono una delle patologie a più grave impatto sociale del mondo.
Anche se il decorso clinico della malattia di Alzheimer è in parte specifico per ogni individuo, la patologia causa diversi sintomi comuni alla maggior parte dei pazienti. I primi sintomi osservabili sono spesso erroneamente considerati problematiche "legate all'età", o manifestazioni di stress. Nelle prime fasi, il sintomo più comune è l'incapacità di acquisire nuovi ricordi e la difficoltà nel ricordare eventi osservati recentemente. Quando si ipotizza la presenza di un possibile morbo di Alzheimer, la diagnosi viene di solito confermata tramite specifiche valutazioni comportamentali e test cognitivi, spesso seguiti dall'imaging a risonanza magnetica.
Con l'avanzare della malattia, il quadro clinico può prevedere confusione, irritabilità e aggressività, sbalzi di umore, difficoltà nel linguaggio, perdita della memoria a lungo termine e progressive disfunzioni sensoriali.
La causa e la progressione della malattia di Alzheimer non sono ancora ben compresi. La ricerca indica che la malattia è associata a placche amiloidi e ammassi neurofibrillari nel cervello Attualmente i trattamenti terapeutici utilizzati offrono importanti benefici sintomatici, e possono parzialmente rallentare il decorso della patologia; anche se sono stati condotti oltre 500 studi clinici per l'identificazione di un possibile trattamento per l'Alzheimer, non sono ancora stati identificati trattamenti che ne arrestino o invertano il decorso. A livello preventivo, sono state proposte diverse modificazioni degli stili di vita personali come potenziali fattori protettivi nei confronti della patologia, ma non vi sono adeguate prove di una correlazione certa tra queste raccomandazioni e la riduzione effettiva della degenerazione. Stimolazione mentale, esercizio fisico e una dieta equilibrata sono state proposte sia come modalità di possibile prevenzione, che come modalità complementari di gestione della malattia.
Poiché per il morbo di Alzheimer non sono attualmente disponibili terapie risolutive ed il suo decorso è progressivo, la gestione dei bisogni dei pazienti diviene essenziale. Spesso è il coniuge o un parente stretto a prendersi in carico il malato (caregiver), compito che comporta notevoli difficoltà e oneri. Chi si occupa del paziente può sperimentare pesanti carichi personali, che possono coinvolgere aspetti sociali, psicologici, fisici ed economici.
Descrizione clinica
Il decorso della malattia può essere diverso, nei tempi e nelle modalità sintomatologiche, per ogni singolo paziente; esistono comunque una serie di sintomi comuni, che si trovano frequentemente associati nelle varie fasi con cui, clinicamente, si suddivide per convenzione il decorso della malattia. Ad una prima fase lieve, fa seguito la fase intermedia, e quindi la fase avanzata/severa; il tempo di permanenza in ciascuna di queste fasi è variabile da soggetto a soggetto, e può in certi casi durare anche diversi anni.
La malattia viene spesso anticipata dal cosiddetto mild cognitive impairment (MCI), un leggero calo di prestazioni in diverse funzioni cognitive in particolare legate alla memoria, all'orientamento o alle capacità verbali. Tale calo cognitivo, che è comunque frequente nella popolazione anziana,non è necessariamente indicativo di demenza incipiente, può in alcuni casi essere seguito dall'avvio delle fasi iniziali dell'Alzheimer.
La malattia si manifesta spesso inizialmente come demenza caratterizzata da amnesia progressiva ed altri deficit cognitivi. Il deficit di memoria è prima circoscritto a sporadici episodi nella vita quotidiana, ovvero disturbi di quella che viene chiamata on-going memory (ricordarsi cosa si è mangiato a pranzo, cosa si è fatto durante il giorno) e della memoria prospettica (che riguarda l'organizzazione del futuro prossimo, come ricordarsi di andare a un appuntamento); poi man mano il deficit aumenta e la perdita della memoria arriva a colpire anche la memoria episodica retrograda (riguardante fatti della propria vita o eventi pubblici del passato) e la memoria semantica (le conoscenze acquisite), mentre la memoria procedurale (che riguarda l'esecuzione automatica di azioni) viene relativamente risparmiata fino alle fasi intermedio-avanzate della malattia.
A partire dalle fasi lievi e intermedie possono poi manifestarsi crescenti difficoltà di produzione del linguaggio, con incapacità nella definizione di nomi di persone od oggetti, e frustranti tentativi di "trovare le parole", seguiti poi nelle fasi più avanzate da disorganizzazione nella produzione di frasi ed uso sovente scorretto del linguaggio (confusione sui significati delle parole, etc.). Sempre nelle fasi lievi-intermedie, la pianificazione e gestione di compiti complessi (gestione di documenti, attività lavorative di concetto, gestione del denaro, guida dell'automobile, cucinare, etc.) iniziano a diventare progressivamente più impegnative e difficili, fino a richiedere assistenza continuativa o divenire impossibili.
Nelle fasi intermedie ed avanzate, inoltre, possono manifestarsi problematiche comportamentali (vagabondaggio, coazione a ripetere movimenti o azioni, reazioni comportamentali incoerenti) o psichiatriche (confusione, ansia, depressione, ed occasionalmente deliri e allucinazioni). Il disorientamento nello spazio, nel tempo o nella persona (ovvero la mancata o confusa consapevolezza di dove si è situati nel tempo, nei luoghi e/o nelle identità personali, proprie o di altri - comprese le difficoltà di riconoscimento degli altri significativi) è sintomo frequente a partire dalle fasi intermedie-avanzate. In tali fasi si aggiungono difficoltà progressive anche nella cura della persona (lavarsi, vestirsi, assumere farmaci, etc.).
Ai deficit cognitivi e comportamentali, nelle fasi più avanzate si aggiungono infine complicanze mediche internistiche, che portano a una compromissione progressiva della salute. Una persona colpita dal morbo può vivere anche una decina di anni dopo la diagnosi clinica di malattia conclamata.
Come sottolineato, col progredire della malattia le persone non solo presentano deficit di memoria, ma risultano deficitarie nelle funzioni strumentali mediate dalla corteccia associativa, e possono pertanto presentare afasia e aprassia, fino a presentare disturbi neurologici e poi internistici; pertanto i pazienti, nelle fasi intermedie ed avanzate, necessitano di continua assistenza personale (solitamente erogata da famigliari e badanti, i cosiddetti caregivers, che sono a loro volta sottoposti ai forti stress tipici di chi assiste i malati di Alzheimer).
La malattia è dovuta a una diffusa distruzione di neuroni, principalmente attribuita alla betamiloide, una proteina che, depositandosi tra i neuroni, agisce come una sorta di collante, inglobando placche e grovigli "neurofibrillari". La malattia è accompagnata da una forte diminuzione di acetilcolina nel cervello (si tratta di un neurotrasmettitore, ovvero di una molecola fondamentale per la comunicazione tra neuroni, e dunque per la memoria e ogni altra facoltà intellettiva). La conseguenza di queste modificazioni cerebrali è l'impossibilità per il neurone di trasmettere gli impulsi nervosi, e quindi la morte dello stesso, con conseguente atrofia progressiva del cervello nel suo complesso.
Storia

Nel 1901, il dottor Alois Alzheimer, uno psichiatra tedesco, intervistò una sua paziente, la signora Auguste D., di 51 anni. Le mostrò parecchi oggetti e successivamente le chiese che cosa le era stato indicato. Lei non poteva però ricordare. Inizialmente registrò il suo comportamento come "disordine da amnesia di scrittura", ma la signora Auguste D. fu la prima paziente a cui venne diagnosticata quella che in seguito sarebbe stata conosciuta come malattia di Alzheimer.
Negli anni successivi vennero registrati in letteratura scientifica undici altri casi simili; nel 1910 la patologia venne inserita per la prima volta dal grande psichiatra tedesco Emil Kraepelin nel suo classico Manuale di Psichiatria, venendo da lui definita come "Malattia di Alzheimer", o "Demenza Presenile". Il termine, inizialmente utilizzato solo per le rare forme "early-onset" (ovvero, con esordio clinico prima dei 65 anni), dopo il 1977 è stato ufficialmente esteso a tutte le forme di Alzheimer.
Patogenesi
A livello neurologico macroscopico, la malattia è caratterizzata da una diminuzione nel peso e nel volume del cervello, dovuta ad atrofia corticale, visibile anche in un allargamento dei solchi e corrispondente appiattimento delle circonvoluzioni.
A livello microscopico e cellulare, sono riscontrabili depauperamento neuronale, placche senili (dette anche placche amiloidi), ammassi neurofibrillari, angiopatia congofila (amiloidea).
Dall'analisi post-mortem di tessuti cerebrali di pazienti affetti da Alzheimer (solo in tale momento si può confermare la diagnosi clinica da un punto di vista anatomo-patologico), si è potuto riscontrare un accumulo extracellulare di una proteina, chiamata Beta-amiloide.
Nei soggetti sani la APP (Amyloid precursor protein, Proteina Progenitrice dell'Amiloide), attraverso una reazione biologica catalizzata dall'alfa-secretasi, produce un peptide innocuo chiamato p3. Per motivi non totalmente chiariti, nei soggetti malati l'enzima che interviene sull'APP non è l'alfa-secretasi ma una sua variante, la beta-secretasi, che porta alla produzione di un peptide di 40-42 aminoacidi: la beta-amiloide.
Tale beta-amiloide non presenta le caratteristiche biologiche della forma naturale, ma tende a depositarsi in aggregati extracellulari sulla membrana dei neuroni. Tali placche neuronali innescano un processo infiammatorio che attiva una risposta immunitaria richiamando macrofagi e neutrofili, i quali produrranno citochine, interleuchine e TNF-alfa che danneggiano irreversibilmente i neuroni.
Ulteriori studi mettono in evidenza che nei malati di Alzheimer interviene un ulteriore meccanismo patologico: all'interno dei neuroni una Proteina Tau, fosforilata in maniera anomala, si accumula nei cosiddetti "aggregati neurofibrillari" (o ammassi neurofibrillari).
Particolarmente colpiti da questo processo patologico sono i neuroni colinergici, specialmente quelli delle aree corticali, sottocorticali e, tra queste ultime, le aree ippocampali. In particolare, l'ippocampo è una struttura encefalica che svolge un ruolo fondamentale nell'apprendimento e nei processi di memorizzazione, perciò la distruzione dei neuroni di queste zone è ritenuta essere la causa principale della perdita di memoria dei malati.
Anche se al momento non esiste una cura efficace, sono state proposte diverse strategie terapeutiche per tentare di influenzare clinicamente il decorso del morbo di Alzheimer; tali strategie puntano a modulare farmacologicamente alcuni dei meccanismi patologici che ne stanno alla base. È inoltre opportuno integrare interventi psicosociali, cognitivi e comportamentali, che hanno dimostrato effetti positivi, sinergicamente all'uso dei presidi farmacologici, nel rallentamento dell'evoluzione dei sintomi e nella qualità della vita dei pazienti e dei caregivers.
Intervento farmacologico
In primo luogo, basandosi sul fatto che nell'Alzheimer si ha diminuzione dei livelli di acetilcolina, un'ipotesi terapeutica è stata quella di provare a ripristinarne i livelli fisiologici. L'acetilcolina pura non può però essere usata, in quanto troppo instabile e con un effetto limitato. Gli agonisti colinergici invece avrebbero effetti sistemici e produrrebbero troppi effetti collaterali, e non sono quindi utilizzabili. Si possono invece usare gli inibitori della colinesterasi, l'enzima che catabolizza l'acetilcolina: inibendo tale enzima, si aumenta la quantità di acetilcolina presente nello spazio intersinaptico.
Sono a disposizione farmaci inibitori dell'acetilcolinesterasi, che hanno una bassa affinità per l'enzima presente in periferia, e che sono sufficientemente lipofili da superare la Barriera emato-encefalica (BEE), e agire quindi di preferenza sul sistema nervoso centrale. Tra questi, la Fisostigmina, la Galantamina e la Neostigmina sono stati i capostipiti, ma l'interesse farmacologico è attualmente maggiormente concentrato sugli inibitori reversibili della acetilcolinesterasi, quali la Rivastigmina e la Galantamina stessa.
Un'altra, più recente, linea d'azione prevede il ricorso a farmaci che agiscano direttamente sul sistema glutamatergico, come la Memantina. La Memantina ha dimostrato un'attività terapeutica, moderata ma positiva, nella parziale riduzione del deterioramento cognitivo in pazienti con Alzheimer da moderato a grave.
La Tacrina non è più utilizzata perché epatotossica, mentre il Donepezil, inibitore non competitivo dell'acetilcolinesterasi, sembrerebbe più efficace perché, con una emivita di circa 70 ore, permette una sola somministrazione al giorno (mentre la Galantamina ha una emivita di 7 ore). Ovviamente però il Donepezil è più soggetto a manifestare effetti collaterali dovuti ad un aumento del tono colinergico (quali insonnia, aritmie, bradicardia, nausea, diarrea). Di contro, la Galantamina e la Rivastigmina possono causare gli stessi effetti, ma in misura molto minore.
Altre ipotesi di approccio farmacoterapico
Oltre alle molecole e strategie di intervento già delineate, sono state variamente proposte altre ipotesi di intervento farmacologico, con evidenze cliniche di efficacia però insufficienti o non confermate.
Tra esse, un'altra ipotesi complementare di approccio alla patologia è legata alla proposta d'uso di FANS (anti-infiammatori non steroidei). Come detto, nell'Alzheimer è presente una dinamica infiammatoria che danneggia i neuroni. L'uso di antiinfiammatori è stato quindi ipotizzato che potrebbe migliorare la condizione clinica dei pazienti. Si è anche notato che le donne in cura post-menopausale con farmaci estrogeni presentano una minor incidenza della patologia (infatti gli estrogeni bloccano la morte neuronale indotta dalla proteina beta-amiloide). Alcuni ricercatori avrebbero messo in evidenza anche la potenziale azione protettiva della vitamina E (alfa-tocoferolo), che sembrerebbe prevenire la perossidazione lipidica delle membrane neuronali causata dal processo infiammatorio; ma ricerche più recenti non hanno confermato l'utilità della vitamina E (né della vitamina C) nella prevenzione primaria e secondaria della patologia, sottolineando anzi i potenziali rischi sanitari legati all'eccessiva e prolungata assunzione di vitamina E.
Sul processo neurodegenerativo può intervenire anche l'eccitotossicità, ossia un'eccessiva liberazione di acidi Glutammico ed Aspartico, entrambi neurotrasmettitori eccitatori, che inducono un aumento del calcio libero intracellulare, il quale è citotossico. Si è quindi ipotizzato di usare farmaci antagonisti del glutammato e dell'aspartato, ma anche questi ultimi presentano notevoli effetti collaterali.
Sono presenti in commercio farmaci definiti Nootropi ("stimolanti del pensiero"), come il Piracetam e l'Aniracetam: questi farmaci aumentano il rilascio di Acido glutammico; anche se questo parrebbe in netta contrapposizione a quanto detto sopra, si deve tenere presente che comunque tale neurotrasmettitore è direttamente implicato nei processi di memorizzazione e di apprendimento. Aumentandone la quantità, è stato ipotizzato di poter contribuire a migliorare i processi cognitivi. Anche in questo caso, l'evidenza clinica di efficacia è scarsa.
Ultimo approccio ipotizzato è l'uso di Pentossifillina e Diidroergotossina (sembra che tali farmaci migliorino il flusso ematico cerebrale, permettendo così una migliore ossigenazione cerebrale, ed un conseguente miglioramento delle performance neuronali). Sempre per lo stesso scopo è stato proposto l'uso del Gingko biloba, ma l'evidenza scientifica a supporto di questa tesi è negativa.

Neuroni della corteccia cerebrale (colori virtuali)
Caratteristiche generali
Essa è stata descritta per la prima volta nel 1906, dallo psichiatra e neuropatologo tedesco Alois Alzheimer. Nel 2006 vi erano 26,6 milioni malati di tutto il mondo, e si stima che ne sarà affetta 1 persona su 85 a livello mondiale entro il 2050.
La sua ampia e crescente diffusione nella popolazione, la limitata e comunque non risolutiva efficacia delle terapie disponibili, e le enormi risorse necessarie per la sua gestione (sociali, emotive, organizzative ed economiche), che ricadono in gran parte sui familiari dei malati, la rendono una delle patologie a più grave impatto sociale del mondo.
Anche se il decorso clinico della malattia di Alzheimer è in parte specifico per ogni individuo, la patologia causa diversi sintomi comuni alla maggior parte dei pazienti. I primi sintomi osservabili sono spesso erroneamente considerati problematiche "legate all'età", o manifestazioni di stress. Nelle prime fasi, il sintomo più comune è l'incapacità di acquisire nuovi ricordi e la difficoltà nel ricordare eventi osservati recentemente. Quando si ipotizza la presenza di un possibile morbo di Alzheimer, la diagnosi viene di solito confermata tramite specifiche valutazioni comportamentali e test cognitivi, spesso seguiti dall'imaging a risonanza magnetica.
Con l'avanzare della malattia, il quadro clinico può prevedere confusione, irritabilità e aggressività, sbalzi di umore, difficoltà nel linguaggio, perdita della memoria a lungo termine e progressive disfunzioni sensoriali.
La causa e la progressione della malattia di Alzheimer non sono ancora ben compresi. La ricerca indica che la malattia è associata a placche amiloidi e ammassi neurofibrillari nel cervello Attualmente i trattamenti terapeutici utilizzati offrono importanti benefici sintomatici, e possono parzialmente rallentare il decorso della patologia; anche se sono stati condotti oltre 500 studi clinici per l'identificazione di un possibile trattamento per l'Alzheimer, non sono ancora stati identificati trattamenti che ne arrestino o invertano il decorso. A livello preventivo, sono state proposte diverse modificazioni degli stili di vita personali come potenziali fattori protettivi nei confronti della patologia, ma non vi sono adeguate prove di una correlazione certa tra queste raccomandazioni e la riduzione effettiva della degenerazione. Stimolazione mentale, esercizio fisico e una dieta equilibrata sono state proposte sia come modalità di possibile prevenzione, che come modalità complementari di gestione della malattia.
Poiché per il morbo di Alzheimer non sono attualmente disponibili terapie risolutive ed il suo decorso è progressivo, la gestione dei bisogni dei pazienti diviene essenziale. Spesso è il coniuge o un parente stretto a prendersi in carico il malato (caregiver), compito che comporta notevoli difficoltà e oneri. Chi si occupa del paziente può sperimentare pesanti carichi personali, che possono coinvolgere aspetti sociali, psicologici, fisici ed economici.
Descrizione clinica

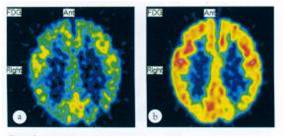
Immagine SPECT del cervello che mostra la ridotta funzione della corteccia cerebrale in una persona con malattia di Alzheimer (a sinistra) posta a confronto con una persona sana (a destra)
Il decorso della malattia può essere diverso, nei tempi e nelle modalità sintomatologiche, per ogni singolo paziente; esistono comunque una serie di sintomi comuni, che si trovano frequentemente associati nelle varie fasi con cui, clinicamente, si suddivide per convenzione il decorso della malattia. Ad una prima fase lieve, fa seguito la fase intermedia, e quindi la fase avanzata/severa; il tempo di permanenza in ciascuna di queste fasi è variabile da soggetto a soggetto, e può in certi casi durare anche diversi anni.
La malattia viene spesso anticipata dal cosiddetto mild cognitive impairment (MCI), un leggero calo di prestazioni in diverse funzioni cognitive in particolare legate alla memoria, all'orientamento o alle capacità verbali. Tale calo cognitivo, che è comunque frequente nella popolazione anziana,non è necessariamente indicativo di demenza incipiente, può in alcuni casi essere seguito dall'avvio delle fasi iniziali dell'Alzheimer.
La malattia si manifesta spesso inizialmente come demenza caratterizzata da amnesia progressiva ed altri deficit cognitivi. Il deficit di memoria è prima circoscritto a sporadici episodi nella vita quotidiana, ovvero disturbi di quella che viene chiamata on-going memory (ricordarsi cosa si è mangiato a pranzo, cosa si è fatto durante il giorno) e della memoria prospettica (che riguarda l'organizzazione del futuro prossimo, come ricordarsi di andare a un appuntamento); poi man mano il deficit aumenta e la perdita della memoria arriva a colpire anche la memoria episodica retrograda (riguardante fatti della propria vita o eventi pubblici del passato) e la memoria semantica (le conoscenze acquisite), mentre la memoria procedurale (che riguarda l'esecuzione automatica di azioni) viene relativamente risparmiata fino alle fasi intermedio-avanzate della malattia.
A partire dalle fasi lievi e intermedie possono poi manifestarsi crescenti difficoltà di produzione del linguaggio, con incapacità nella definizione di nomi di persone od oggetti, e frustranti tentativi di "trovare le parole", seguiti poi nelle fasi più avanzate da disorganizzazione nella produzione di frasi ed uso sovente scorretto del linguaggio (confusione sui significati delle parole, etc.). Sempre nelle fasi lievi-intermedie, la pianificazione e gestione di compiti complessi (gestione di documenti, attività lavorative di concetto, gestione del denaro, guida dell'automobile, cucinare, etc.) iniziano a diventare progressivamente più impegnative e difficili, fino a richiedere assistenza continuativa o divenire impossibili.
Nelle fasi intermedie ed avanzate, inoltre, possono manifestarsi problematiche comportamentali (vagabondaggio, coazione a ripetere movimenti o azioni, reazioni comportamentali incoerenti) o psichiatriche (confusione, ansia, depressione, ed occasionalmente deliri e allucinazioni). Il disorientamento nello spazio, nel tempo o nella persona (ovvero la mancata o confusa consapevolezza di dove si è situati nel tempo, nei luoghi e/o nelle identità personali, proprie o di altri - comprese le difficoltà di riconoscimento degli altri significativi) è sintomo frequente a partire dalle fasi intermedie-avanzate. In tali fasi si aggiungono difficoltà progressive anche nella cura della persona (lavarsi, vestirsi, assumere farmaci, etc.).
Ai deficit cognitivi e comportamentali, nelle fasi più avanzate si aggiungono infine complicanze mediche internistiche, che portano a una compromissione progressiva della salute. Una persona colpita dal morbo può vivere anche una decina di anni dopo la diagnosi clinica di malattia conclamata.
Come sottolineato, col progredire della malattia le persone non solo presentano deficit di memoria, ma risultano deficitarie nelle funzioni strumentali mediate dalla corteccia associativa, e possono pertanto presentare afasia e aprassia, fino a presentare disturbi neurologici e poi internistici; pertanto i pazienti, nelle fasi intermedie ed avanzate, necessitano di continua assistenza personale (solitamente erogata da famigliari e badanti, i cosiddetti caregivers, che sono a loro volta sottoposti ai forti stress tipici di chi assiste i malati di Alzheimer).
La malattia è dovuta a una diffusa distruzione di neuroni, principalmente attribuita alla betamiloide, una proteina che, depositandosi tra i neuroni, agisce come una sorta di collante, inglobando placche e grovigli "neurofibrillari". La malattia è accompagnata da una forte diminuzione di acetilcolina nel cervello (si tratta di un neurotrasmettitore, ovvero di una molecola fondamentale per la comunicazione tra neuroni, e dunque per la memoria e ogni altra facoltà intellettiva). La conseguenza di queste modificazioni cerebrali è l'impossibilità per il neurone di trasmettere gli impulsi nervosi, e quindi la morte dello stesso, con conseguente atrofia progressiva del cervello nel suo complesso.
Storia

La signora Auguste D, paziente del dottor Alois Alzheimer, il primo caso documentato della malattia
Nel 1901, il dottor Alois Alzheimer, uno psichiatra tedesco, intervistò una sua paziente, la signora Auguste D., di 51 anni. Le mostrò parecchi oggetti e successivamente le chiese che cosa le era stato indicato. Lei non poteva però ricordare. Inizialmente registrò il suo comportamento come "disordine da amnesia di scrittura", ma la signora Auguste D. fu la prima paziente a cui venne diagnosticata quella che in seguito sarebbe stata conosciuta come malattia di Alzheimer.
Negli anni successivi vennero registrati in letteratura scientifica undici altri casi simili; nel 1910 la patologia venne inserita per la prima volta dal grande psichiatra tedesco Emil Kraepelin nel suo classico Manuale di Psichiatria, venendo da lui definita come "Malattia di Alzheimer", o "Demenza Presenile". Il termine, inizialmente utilizzato solo per le rare forme "early-onset" (ovvero, con esordio clinico prima dei 65 anni), dopo il 1977 è stato ufficialmente esteso a tutte le forme di Alzheimer.
Patogenesi

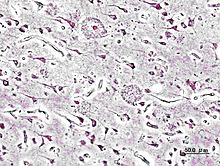
Immagine istopatologica di placche senili nella corteccia cerebrale di una persona affetta da Morbo di Alzheimer
A livello neurologico macroscopico, la malattia è caratterizzata da una diminuzione nel peso e nel volume del cervello, dovuta ad atrofia corticale, visibile anche in un allargamento dei solchi e corrispondente appiattimento delle circonvoluzioni.
A livello microscopico e cellulare, sono riscontrabili depauperamento neuronale, placche senili (dette anche placche amiloidi), ammassi neurofibrillari, angiopatia congofila (amiloidea).
Dall'analisi post-mortem di tessuti cerebrali di pazienti affetti da Alzheimer (solo in tale momento si può confermare la diagnosi clinica da un punto di vista anatomo-patologico), si è potuto riscontrare un accumulo extracellulare di una proteina, chiamata Beta-amiloide.
Nei soggetti sani la APP (Amyloid precursor protein, Proteina Progenitrice dell'Amiloide), attraverso una reazione biologica catalizzata dall'alfa-secretasi, produce un peptide innocuo chiamato p3. Per motivi non totalmente chiariti, nei soggetti malati l'enzima che interviene sull'APP non è l'alfa-secretasi ma una sua variante, la beta-secretasi, che porta alla produzione di un peptide di 40-42 aminoacidi: la beta-amiloide.
Tale beta-amiloide non presenta le caratteristiche biologiche della forma naturale, ma tende a depositarsi in aggregati extracellulari sulla membrana dei neuroni. Tali placche neuronali innescano un processo infiammatorio che attiva una risposta immunitaria richiamando macrofagi e neutrofili, i quali produrranno citochine, interleuchine e TNF-alfa che danneggiano irreversibilmente i neuroni.
Ulteriori studi mettono in evidenza che nei malati di Alzheimer interviene un ulteriore meccanismo patologico: all'interno dei neuroni una Proteina Tau, fosforilata in maniera anomala, si accumula nei cosiddetti "aggregati neurofibrillari" (o ammassi neurofibrillari).
Particolarmente colpiti da questo processo patologico sono i neuroni colinergici, specialmente quelli delle aree corticali, sottocorticali e, tra queste ultime, le aree ippocampali. In particolare, l'ippocampo è una struttura encefalica che svolge un ruolo fondamentale nell'apprendimento e nei processi di memorizzazione, perciò la distruzione dei neuroni di queste zone è ritenuta essere la causa principale della perdita di memoria dei malati.
Terapia
Anche se al momento non esiste una cura efficace, sono state proposte diverse strategie terapeutiche per tentare di influenzare clinicamente il decorso del morbo di Alzheimer; tali strategie puntano a modulare farmacologicamente alcuni dei meccanismi patologici che ne stanno alla base. È inoltre opportuno integrare interventi psicosociali, cognitivi e comportamentali, che hanno dimostrato effetti positivi, sinergicamente all'uso dei presidi farmacologici, nel rallentamento dell'evoluzione dei sintomi e nella qualità della vita dei pazienti e dei caregivers.
Intervento farmacologico
In primo luogo, basandosi sul fatto che nell'Alzheimer si ha diminuzione dei livelli di acetilcolina, un'ipotesi terapeutica è stata quella di provare a ripristinarne i livelli fisiologici. L'acetilcolina pura non può però essere usata, in quanto troppo instabile e con un effetto limitato. Gli agonisti colinergici invece avrebbero effetti sistemici e produrrebbero troppi effetti collaterali, e non sono quindi utilizzabili. Si possono invece usare gli inibitori della colinesterasi, l'enzima che catabolizza l'acetilcolina: inibendo tale enzima, si aumenta la quantità di acetilcolina presente nello spazio intersinaptico.
Sono a disposizione farmaci inibitori dell'acetilcolinesterasi, che hanno una bassa affinità per l'enzima presente in periferia, e che sono sufficientemente lipofili da superare la Barriera emato-encefalica (BEE), e agire quindi di preferenza sul sistema nervoso centrale. Tra questi, la Fisostigmina, la Galantamina e la Neostigmina sono stati i capostipiti, ma l'interesse farmacologico è attualmente maggiormente concentrato sugli inibitori reversibili della acetilcolinesterasi, quali la Rivastigmina e la Galantamina stessa.
Un'altra, più recente, linea d'azione prevede il ricorso a farmaci che agiscano direttamente sul sistema glutamatergico, come la Memantina. La Memantina ha dimostrato un'attività terapeutica, moderata ma positiva, nella parziale riduzione del deterioramento cognitivo in pazienti con Alzheimer da moderato a grave.
La Tacrina non è più utilizzata perché epatotossica, mentre il Donepezil, inibitore non competitivo dell'acetilcolinesterasi, sembrerebbe più efficace perché, con una emivita di circa 70 ore, permette una sola somministrazione al giorno (mentre la Galantamina ha una emivita di 7 ore). Ovviamente però il Donepezil è più soggetto a manifestare effetti collaterali dovuti ad un aumento del tono colinergico (quali insonnia, aritmie, bradicardia, nausea, diarrea). Di contro, la Galantamina e la Rivastigmina possono causare gli stessi effetti, ma in misura molto minore.
Altre ipotesi di approccio farmacoterapico
Oltre alle molecole e strategie di intervento già delineate, sono state variamente proposte altre ipotesi di intervento farmacologico, con evidenze cliniche di efficacia però insufficienti o non confermate.
Tra esse, un'altra ipotesi complementare di approccio alla patologia è legata alla proposta d'uso di FANS (anti-infiammatori non steroidei). Come detto, nell'Alzheimer è presente una dinamica infiammatoria che danneggia i neuroni. L'uso di antiinfiammatori è stato quindi ipotizzato che potrebbe migliorare la condizione clinica dei pazienti. Si è anche notato che le donne in cura post-menopausale con farmaci estrogeni presentano una minor incidenza della patologia (infatti gli estrogeni bloccano la morte neuronale indotta dalla proteina beta-amiloide). Alcuni ricercatori avrebbero messo in evidenza anche la potenziale azione protettiva della vitamina E (alfa-tocoferolo), che sembrerebbe prevenire la perossidazione lipidica delle membrane neuronali causata dal processo infiammatorio; ma ricerche più recenti non hanno confermato l'utilità della vitamina E (né della vitamina C) nella prevenzione primaria e secondaria della patologia, sottolineando anzi i potenziali rischi sanitari legati all'eccessiva e prolungata assunzione di vitamina E.
Sul processo neurodegenerativo può intervenire anche l'eccitotossicità, ossia un'eccessiva liberazione di acidi Glutammico ed Aspartico, entrambi neurotrasmettitori eccitatori, che inducono un aumento del calcio libero intracellulare, il quale è citotossico. Si è quindi ipotizzato di usare farmaci antagonisti del glutammato e dell'aspartato, ma anche questi ultimi presentano notevoli effetti collaterali.
Sono presenti in commercio farmaci definiti Nootropi ("stimolanti del pensiero"), come il Piracetam e l'Aniracetam: questi farmaci aumentano il rilascio di Acido glutammico; anche se questo parrebbe in netta contrapposizione a quanto detto sopra, si deve tenere presente che comunque tale neurotrasmettitore è direttamente implicato nei processi di memorizzazione e di apprendimento. Aumentandone la quantità, è stato ipotizzato di poter contribuire a migliorare i processi cognitivi. Anche in questo caso, l'evidenza clinica di efficacia è scarsa.
Ultimo approccio ipotizzato è l'uso di Pentossifillina e Diidroergotossina (sembra che tali farmaci migliorino il flusso ematico cerebrale, permettendo così una migliore ossigenazione cerebrale, ed un conseguente miglioramento delle performance neuronali). Sempre per lo stesso scopo è stato proposto l'uso del Gingko biloba, ma l'evidenza scientifica a supporto di questa tesi è negativa.